ইংরেজি নাম: Nitrogen আমাদের চারপাশে বিরাজমান নাইট্রোজেন একটি বর্ণহীন, গন্ধহীন, স্বাদহীন মৌলিক পদার্থ। পৃথিবীর বায়ুমণ্ডলের ৭৮.০৯% নাইট্রোজেন রয়েছে। এর প্রতীক N। পারমাণিবক সংখ্যা ৭। ইলেকট্রন বিন্যাস 1s^2 2s^2 2p^3 । শক্তিস্তরে ইলেকট্রন সংখ্যা : ২,৫। পারমাণবিক ওজন : ১৪.০০৬৭। এটি 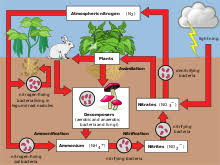 পৃথিবীর সাধারণ কক্ষীয় তাপামাত্রায় গ্যাসীয় অবস্থায় থাকে। এর গলনাঙ্ক : -২১০০.০০ ডিগ্রি সেলসিয়াস, স্ফুটনাঙ্ক : -১৯৫.৭৯ ডিগ্রি সেলসিয়াস। এর ২টি সুস্থির আইসোটোপ রয়েছে এই আইসোটোপ দুটিহলো— ১৪N : এর নিউট্রোন সংখ্যা ৭টি। ১৫N : এর নিউট্রোন সংখ্যা ৮টি। এক সময় বাতাস একটি বিশুদ্ধ গ্যাসীয় পদার্থ হিসাবে বিবেচনা করা হতো। মানব সভ্যতার গোড়া থেকেই মানুষ নাইট্রোজেন ঘটিত বিভিন্ন যৌগিক পদার্থের সাথে পরিচিত ছিল। যেমন সোরা বা নাইট্রিক এ্যাসিড ব্যবহৃত হতো বেশ আগে থেকেই। ১৭৬৭ খ্রিষ্টাব্দের দিকে ক্যাভেন্ডিশ, জে প্রিস্টলে-সহ আরও অনেক গবেষক বাতাস নিয়ে গবেষণা শুরু করেন। এঁরা মূলত পরীক্ষা করেছিলেন গ্যাসের উপর বিদ্যুৎক্ষরণের প্রতিক্রিয়া। গোড়ার দিকে বাতাসকে তিনটি ভাগে ভাগ করা হয়েছিল। ভাগ তিনটি হলো— সাধারণ বাতাস, বদ্ধ বাতাস ও দাহ্য বাতাস। ১৭৭২ খ্রিষ্টাব্দে রাদারফোর্ড এই গ্যাসটি আবিষ্কার করেন। তিনি এই গ্যাসটির নামকরণ করেছিলেন ক্ষতিকারক বাতাস (noxious air) বা বদ্ধ বাতাস (fixed air)। প্রথমদিকে বিজ্ঞানীরা এর নাম রেখেছিলেন এ্যাজোট (azote)। উল্লেখ্য গ্রিক ãζωτος শব্দের অর্থ হলো—জীবনহীন। ১৭৮৭ খ্রিষ্টাব্দে এর নাম নাইট্রোজেন রাখেন ল্যাভয়সিয়ের। ১৭৭৪ খ্রিষ্টাব্দে প্রিস্টলে অক্সিজেন আবিষ্কার করেন। সেই সূত্রে প্রিস্টলে রসায়ন বিজ্ঞানী হিসাবে খ্যাতি লাভ করেন। ১৭৭৭ খ্রিষ্টাব্দে ক্যাভেন্ডিশ এক চিঠিতে জে প্রিস্টলে-কে জানান যে, তিনি নতুন এক ধরনের বিষাক্ত প্রস্তুত করেছেন। তিনি বায়ুমণ্ডলের বাতাসকে লোহিততপ্ত কয়লার উপর দিয়ে বার বার প্রবাহিত করে, তা একটি পাত্রে আবদ্ধ করেন। পরে ওই বাতাসকে ক্ষার দ্বারা শোষিত করান। এর ফলে অবশিষ্ট যে বাতাস তিনি পান, তা শ্বাসের অনুপুযুক্ত ছিল। এরপর উভয় বিজ্ঞানী এ বিষয়ে কোনো গবেষণা করেন নি। রসয়ানাগারে এই গ্যাস তৈরি করা হয় এ্যামোনিয়াম ক্লোরাইট ও সোডিয়াম ক্লোরাইটের রাসায়ানিক বিক্রিয়ার দ্বারা। NH4Cl + NaNO2→ N2 + NaCl + 2H2O শিল্পক্ষেত্রে বাতাসকে তরল করে, আংশিক পাতন পদ্ধতিতে নাইট্রোজেন উৎপন্ন করা হয়। সাধারণ চাপে ও তাপমাত্রায় নাইট্রোজনে নিষ্ক্রিয় গ্যাস হিসেবেই থাকে। কারণ এর অণু ত্রিবন্ধনে যুক্ত থাকে। অণুজীবী দ্বারা নাইট্রোজেনের বন্ধন ভেঙে গিয়ে নানা রকমের যৌগিক পদার্থের সৃষ্টি করে। প্রকৃতিতে নাইট্রোজোনের এই চক্র প্রতিনিয়ত চলছে। উচ্চ তাপমাত্রায় এ্যালুমিনিয়াম, ক্যালসিয়াম, ক্রোমোয়াম, টাইটেনিয়াম, বেরিয়াম, বেরিলিয়াম, বোরন, ম্যাগনেশিয়াম, লিথিয়াম, সিলিকন ও স্ট্রানসিয়ামের সাথে বিক্রয়া করে নাইট্রেট উৎপন্ন করে। বজ্রপাতের সময় বাতাসের অক্সিজেনের সাথে নাইট্রোজেন বিক্রিয়া করে নাইট্রাস মনোক্সাইড উৎপন্ন করে। কিন্তু উচ্চাতাপ, মধ্যম চাপে অনুঘটকের সাহায্যে অ্যামোনিয়া উৎপন্ন হয়। জীবজগতে নাইট্রোজেন একটি গুরুত্বপূর্ণ মৌলিক উপাদান হিসেবে বিবেচিত হয়ে থাকে। প্রোটিন, নিউক্লিক অ্যাসিডে, কো-এনজাইমে নাইট্রোজেন থাকে। [দ্র:নির্ভরযোগ্য উৎস হতে সংগৃহীত]
পৃথিবীর সাধারণ কক্ষীয় তাপামাত্রায় গ্যাসীয় অবস্থায় থাকে। এর গলনাঙ্ক : -২১০০.০০ ডিগ্রি সেলসিয়াস, স্ফুটনাঙ্ক : -১৯৫.৭৯ ডিগ্রি সেলসিয়াস। এর ২টি সুস্থির আইসোটোপ রয়েছে এই আইসোটোপ দুটিহলো— ১৪N : এর নিউট্রোন সংখ্যা ৭টি। ১৫N : এর নিউট্রোন সংখ্যা ৮টি। এক সময় বাতাস একটি বিশুদ্ধ গ্যাসীয় পদার্থ হিসাবে বিবেচনা করা হতো। মানব সভ্যতার গোড়া থেকেই মানুষ নাইট্রোজেন ঘটিত বিভিন্ন যৌগিক পদার্থের সাথে পরিচিত ছিল। যেমন সোরা বা নাইট্রিক এ্যাসিড ব্যবহৃত হতো বেশ আগে থেকেই। ১৭৬৭ খ্রিষ্টাব্দের দিকে ক্যাভেন্ডিশ, জে প্রিস্টলে-সহ আরও অনেক গবেষক বাতাস নিয়ে গবেষণা শুরু করেন। এঁরা মূলত পরীক্ষা করেছিলেন গ্যাসের উপর বিদ্যুৎক্ষরণের প্রতিক্রিয়া। গোড়ার দিকে বাতাসকে তিনটি ভাগে ভাগ করা হয়েছিল। ভাগ তিনটি হলো— সাধারণ বাতাস, বদ্ধ বাতাস ও দাহ্য বাতাস। ১৭৭২ খ্রিষ্টাব্দে রাদারফোর্ড এই গ্যাসটি আবিষ্কার করেন। তিনি এই গ্যাসটির নামকরণ করেছিলেন ক্ষতিকারক বাতাস (noxious air) বা বদ্ধ বাতাস (fixed air)। প্রথমদিকে বিজ্ঞানীরা এর নাম রেখেছিলেন এ্যাজোট (azote)। উল্লেখ্য গ্রিক ãζωτος শব্দের অর্থ হলো—জীবনহীন। ১৭৮৭ খ্রিষ্টাব্দে এর নাম নাইট্রোজেন রাখেন ল্যাভয়সিয়ের। ১৭৭৪ খ্রিষ্টাব্দে প্রিস্টলে অক্সিজেন আবিষ্কার করেন। সেই সূত্রে প্রিস্টলে রসায়ন বিজ্ঞানী হিসাবে খ্যাতি লাভ করেন। ১৭৭৭ খ্রিষ্টাব্দে ক্যাভেন্ডিশ এক চিঠিতে জে প্রিস্টলে-কে জানান যে, তিনি নতুন এক ধরনের বিষাক্ত প্রস্তুত করেছেন। তিনি বায়ুমণ্ডলের বাতাসকে লোহিততপ্ত কয়লার উপর দিয়ে বার বার প্রবাহিত করে, তা একটি পাত্রে আবদ্ধ করেন। পরে ওই বাতাসকে ক্ষার দ্বারা শোষিত করান। এর ফলে অবশিষ্ট যে বাতাস তিনি পান, তা শ্বাসের অনুপুযুক্ত ছিল। এরপর উভয় বিজ্ঞানী এ বিষয়ে কোনো গবেষণা করেন নি। রসয়ানাগারে এই গ্যাস তৈরি করা হয় এ্যামোনিয়াম ক্লোরাইট ও সোডিয়াম ক্লোরাইটের রাসায়ানিক বিক্রিয়ার দ্বারা। NH4Cl + NaNO2→ N2 + NaCl + 2H2O শিল্পক্ষেত্রে বাতাসকে তরল করে, আংশিক পাতন পদ্ধতিতে নাইট্রোজেন উৎপন্ন করা হয়। সাধারণ চাপে ও তাপমাত্রায় নাইট্রোজনে নিষ্ক্রিয় গ্যাস হিসেবেই থাকে। কারণ এর অণু ত্রিবন্ধনে যুক্ত থাকে। অণুজীবী দ্বারা নাইট্রোজেনের বন্ধন ভেঙে গিয়ে নানা রকমের যৌগিক পদার্থের সৃষ্টি করে। প্রকৃতিতে নাইট্রোজোনের এই চক্র প্রতিনিয়ত চলছে। উচ্চ তাপমাত্রায় এ্যালুমিনিয়াম, ক্যালসিয়াম, ক্রোমোয়াম, টাইটেনিয়াম, বেরিয়াম, বেরিলিয়াম, বোরন, ম্যাগনেশিয়াম, লিথিয়াম, সিলিকন ও স্ট্রানসিয়ামের সাথে বিক্রয়া করে নাইট্রেট উৎপন্ন করে। বজ্রপাতের সময় বাতাসের অক্সিজেনের সাথে নাইট্রোজেন বিক্রিয়া করে নাইট্রাস মনোক্সাইড উৎপন্ন করে। কিন্তু উচ্চাতাপ, মধ্যম চাপে অনুঘটকের সাহায্যে অ্যামোনিয়া উৎপন্ন হয়। জীবজগতে নাইট্রোজেন একটি গুরুত্বপূর্ণ মৌলিক উপাদান হিসেবে বিবেচিত হয়ে থাকে। প্রোটিন, নিউক্লিক অ্যাসিডে, কো-এনজাইমে নাইট্রোজেন থাকে। [দ্র:নির্ভরযোগ্য উৎস হতে সংগৃহীত] 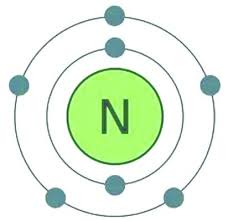
শেয়ার করুন বন্ধুর সাথে